
0431 质谱法
质谱法是先将物质离子化,再按质荷比(m/z)将离子分离,通过测量离子的质荷比和谱峰响应强度而实现分析目标的一种方法。质量是物质的固有特征之一,不同的物质有不同的质量谱,利用物质的上述性质,可进行定性分析。利用物质的质谱峰响应强度与其物质量之间的相关性,可进行定量分析。根据样品中的待测成分可分为无机质谱、有机质谱和同位素质谱。
质谱法主要用于中药、化学药和生物药的研发、生产和上市后质量监测与评价。在真菌毒素(通则2351和指导原则9305)、农药残留(通则2341)、药品杂质(指导原则9102)、金属元素(通则2321、通则2322、通则3208、指导原则9304)、色素(指导原则9303)、药物(通则3405、指导原则9015)及其代谢物、内源性核酸和蛋白质等微量或复杂成分分析中应用广泛。质谱法还可用于细菌、真菌分类与鉴定、分子成像分析等。
质谱仪主要由进样系统、离子源、质量分析器、检测器、真空系统、控制和数据处理系统组成(图1)。真空系统由机械泵、扩散泵或涡轮分子泵、阀件等组成。离子源产生的正离子或负离子,经加速进入质量分析器分离,再由检测器检测。控制和数据处理系统用于控制仪器,记录、处理并储存数据,当配有标准谱库或数据库软件时,可将测得的质谱图谱或数据与标准图谱或数据比对,获得样品中待测成分可能的组成和结构信息。
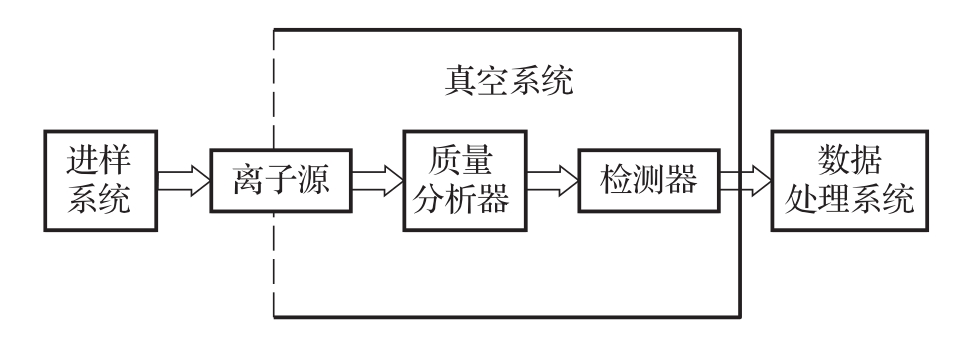
图1 质谱仪的主要组成
一、进样系统
进样方式可分为直接进样和联用进样,选用的进样方式取决于样品的性质、纯度及离子化方式。多种分离技术或其他技术已实现与质谱的联用,经分离后或经其他技术处理的待测成分,通过适宜的接口引入质谱仪分析。样品引入应不影响质谱仪的真空度。
1.直接进样
室温常压下,气态或液态样品中的中性分子通过可控漏孔系统进入离子源。吸附于固体或溶解于液体的挥发性待测成分,可采用顶空分析法提取或富集,经程序升温解吸附后,再由毛细管引入质谱仪。
挥发性固体样品可置于进样杆顶端,在接近离子源的高真空状态下加热、气化。采用解吸离子化技术,可使热不稳定、难挥发的样品在气化的同时实现离子化。
2.联用进样
(1)气相色谱-质谱联用(GC-MS)
当使用毛细管气相色谱柱及高容量质谱真空泵时,可直接将色谱流出物引入质谱仪。
(2)液相色谱-质谱联用(LC-MS)
采用特定的离子源,如电喷雾离子源、大气压化学离子源等使待测成分从色谱流出物中分离并形成适于质谱分析的离子。为减少污染,避免化学噪声和电离抑制,流动相中的缓冲盐或添加剂应具有挥发性,并尽量减少用量。
(3)超临界流体色谱-质谱联用(SFC-MS)
采用电喷雾离子源或大气压化学离子源等。色谱流出物通过色谱柱和离子源之间的加热限流器转变为气态后,引入质谱仪。
(4)毛细管电泳-质谱联用(CE-MS)
电喷雾离子源是最常用的接口。采用不同的毛细管电泳操作模式与质谱联用时,应注意毛细管电泳的低流速特点,并使用挥发性缓冲液。
(5)薄层色谱-质谱联用(TLC-MS)
采用基质辅助激光解吸离子源等接口,将薄层板中的待测成分经提取或解吸附并离子化后引入质谱仪。
(6)热重分析-质谱联用(TGA-MS)
电子轰击离子源是最常用的接口。将热分析过程中逸出的气体或高温分解产生的气体离子化后引入质谱仪。
(7)微流控芯片-质谱联用(Microfluidics-MS)
电喷雾离子源和基质辅助激光解吸离子源是最常用的接口。将流出物离子化后引入质谱仪。
(8)质谱成像(MS Imaging)
将样品或处理后的样品置于样品台,光学确认表面形态并选择目标成像区域,采用基质辅助激光解吸离子源或解吸电喷雾离子源等接口,通过待测成分的质荷比对应的响应强度及其坐标位置构建质谱图像。
二、离子源
根据待测成分的性质及拟获取的信息类型,选用适宜的离子源。电子轰击离子源、电喷雾离子源和基质辅助激光解吸离子源等是最常用的离子源。
1.电子轰击离子源(EI)
离子源内的气态待测成分分子,在能量(通常是70eV)大于其电离能的电子轰击下离子化。质谱图中往往含有待测成分的分子离子及其碎片离子。适用于热稳定、易挥发待测成分的离子化,是气相色谱-质谱联用最常用的离子源。
2.化学离子源(CI)
离子源内的甲烷、异丁烷或氨气等试剂气分子在高能电子轰击下离子化,经离子-分子反应产生稳定的试剂气离子,再将待测成分离子化。可产生待测成分(M)的(M+H)+(M-H)-或待测成分与试剂气分子产生的加合离子。与电子轰击离子源相比,化学离子源获得的碎片离子较少,适用于热稳定、易挥发待测成分的离子化。
3.快原子轰击(FAB)或快离子轰击离子源(LSIMS)
氩气等高能中性原子或高能铯离子,将置于金属表面、分散于甘油等惰性黏稠基质中的待测成分离子化,产生(M+H)+(M-H)-或待测成分与基质分子的加合离子。适用于样品中极性、热不稳定待测成分的分子质量测定及结构表征,广泛应用于分子质量高达10 000u的肽、抗生素、核苷酸、脂质、有机金属化合物及表面活性剂的分析。
当用于液相色谱-质谱联用时,需在流动相中添加1%~10%的甘油等惰性黏稠基质,并采用1~10μl/min的低流速。
4.基质辅助激光解吸离子源(MALDI)
将溶于适宜基质中的样品涂布于金属靶上,经高强度紫外或红外脉冲激光照射后,实现待测成分的离子化。可用于分子质量在100 000u以上的生物大分子分析,适宜与飞行时间质量分析器结合使用。
5.电喷雾离子源(ESI)
离子化在大气压下进行。待测成分的溶液或色谱流出物通过毛细管进入离子源,在气体辅助雾化及高压电场作用下形成微小液滴去溶剂化后,气态离子再经逐级减压,传送到具有高真空度的质量分析器中。可在1μl/min~1ml/min流速下进行,适用于极性化合物和生物大分子的离子化,是液相色谱-质谱联用、毛细管电泳-质谱联用的常用离子源。
6.大气压化学离子源(APCI)
原理与化学离子源相同,但离子化在大气压下进行。待测成分的溶液或色谱流出物在高温及氮气流的作用下雾化成气态,经带有高压的放电电极离子化,试剂气离子与待测成分分子发生离子-分子反应,形成单电荷离子。常用于分析有一定挥发性的中等极性与弱极性化合物,是液相色谱-质谱联用的重要离子化技术之一。通常在较高流速下进行,有时可高达2ml/min。
7.大气压光离子源(APPI)
利用光子将气相中的分子离子化,主要用于非极性化合物的离子化,是电喷雾离子源、大气压化学离子源的一种补充。大气压光离子源对试验条件敏感,掺杂剂、溶剂及缓冲溶液的组成等均会对测定的选择性、灵敏度产生显著影响。
8.电感耦合等离子体电离源(ICP)
利用高温等离子体将待测成分的原子或分子离子化为带电离子。主要用于元素分析。
三、质量分析器
质量范围、质量准确度和分辨率是质量分析器的主要性能指标。质量范围指质量分析器能够测定的质荷比下限和质荷比上限之间的范围。质量准确度是指测量质荷比与理论质荷比之间的偏差。分辨率是质量分析器对相邻两个质谱峰的区分能力。高分辨质谱仪通常指其质量分析器的分辨率大于104。四极杆质量分析器、离子阱质量分析器、飞行时间质量分析器和傅里叶变换质量分析器等是最常用的质量分析器。
1.扇形磁场质量分析器(Magnetic sector mass analyzer)
离子源中产生的离子经加速电压(V)加速,聚焦进入扇形磁场(磁场强度B)。在磁场的作用下,不同质荷比的离子发生偏转,按各自的曲率半径(r)运动:
m/z=B2r2/2V
改变磁场强度,可使不同质荷比的离子具有相同的运动曲率半径(r),进而通过狭缝出口,到达检测器。
扇形磁场分析器可检测分子质量高达15 000u的单电荷离子。当与静电场质量分析器结合、构成双聚焦扇形磁场质量分析器时,分辨率可达105。
2.四极杆质量分析器(Q)
由四个平行排列的金属杆状电极组成。直流电压(DC)和射频电压(RF)作用于电极上,形成了高频振荡电场(四极场)。在特定的直流电压和射频电压条件下,一定质荷比的离子可稳定穿过四极场,到达检测器。改变直流电压和射频电压,但保持其比值恒定,可实现质谱扫描。
四极杆质量分析器可检测的单电荷分子质量上限通常是4000u,分辨率约为103。
3.离子阱质量分析器(IT)
可分为三维离子阱质量分析器(3D ion trap)及线性离子阱质量分析器(LIT)。
三维离子阱质量分析器由一对环形电极和两个呈双曲面形的端盖电极组成。端盖电极接地,在环形电极上施加射频电压(RF),形成三维四极场。逐渐增大射频电压的最高值,质荷比从小到大的离子逐次进入不稳定区,由端盖极上的小孔射出。挥发性待测成分的离子化和质量分析可以在同一四极场内完成。通过设定时间序列,单个四极离子阱可以实现多级质谱(MSn)的功能。
线性离子阱质量分析器结构上与四极杆质量分析器等同,但操作模式与三维离子阱质量分析器相似。线性离子阱质量分析器具有更好的离子储存效率和储存容量,可改善离子喷射效率并获得更快的扫描速度和较高的检测灵敏度。
离子阱质量分析器与四极杆质量分析器具有相近的质量范围上限及分辨率。
4.飞行时间质量分析器(TOF)
具有相同动能、不同质量的离子,因飞行速度不同而实现分离。当飞行距离一定时,离子飞行需要的时间与质荷比的平方根成正比,质量小的离子先到达检测器。为明确起始飞行时间并测定飞行时间,以不连续的组将离子引入质量分析器。离子组可由基质辅助激光解吸离子化等脉冲式离子化产生,也可通过门控系统将连续产生的离子流在给定时间引入飞行管。
飞行时间分析器的单电荷质量分析上限约15 000u、离子传输效率高、谱图获取速度快、质量分辨率大于104。
5.傅里叶变换质量分析器(FTMS)
主要有傅里叶变换离子回旋共振质量分析器(FTICR)和傅里叶变换静电场轨道阱质量分析器(Fourier transform orbitrap mass analyzer)。
傅里叶变换离子回旋共振质量分析器是在高真空(~10-7Pa)状态下,离子在超导磁场中作回旋运动,运行轨道随着共振交变电场而改变。当交变电场频率和离子回旋频率相同时,离子被稳定加速,轨道半径越来越大,动能不断增加。关闭交变电场,轨道上的离子在电极上产生交变的镜像电流。利用计算机进行傅里叶变换,将镜像电流信号转换为频谱信号,获得质谱。单电荷质量范围上限大于10 000u,分辨率高达106,可进行多级质谱(MSn)分析。
傅里叶变换静电场轨道阱质量分析器形如纺锤体,由纺锤体中心内电极和左右两个外纺锤半电极组成。当中心电极逐渐施加直流高压后,阱内产生特殊几何结构的静电场。当离子进入静电场轨道阱后,受到中心电场的引力,以及垂直方向的离心力和水平方向的推力,沿中心内电极做水平和垂直方向的振荡。外电极检测离子振荡产生的感应电势,通过傅里叶变换将其转换为质谱信号。单电荷质量范围上限可达10 000u,分辨率高达105。
6.同位素质谱(IMS)
带电离子在高压电场力的作用下获得能量,经聚焦后成一束截面为矩形的离子束,定向射入一个固定的磁场,不同质荷比的同位素离子经磁分离器后实现分离。利用离子流的强度与不同质荷比离子的数量相关性,测定同位素之间的比值,对于只有同位素之间比值差异的化合物,可进行定量测定。
7.串联质谱(Tandem MS)
串联质谱是时间上或空间上两级以上质量分析器的结合,测定第一级质量分析器中的前体离子(precursor ion)与第二级质量分析器中的产物离子(product ion)之间的质量关系。多级质谱实验常以MSn表示。
(1)四极杆串联质谱
三重四极杆串联质谱(QqQ)由三组四极杆串联。第一级四极杆质量分析器(Q1)用于选择前体离子,第二级四极杆质量分析器(Q2)用于碎裂Q1选择的前体离子,第三级四极杆质量分析器(Q3)用于产物离子分析。主要用于定量分析,也可进行定性分析。
四极杆离子阱串联质谱(Q-IT)将四极杆质量分析器的扫描速度与离子阱质量分析器多级质谱功能相结合,获得一级和多级质谱,是定性和定量分析的常用技术。
四极杆质量分析器还可与飞行时间质量分析器或静电场轨道阱质量分析器串联。将四极杆质量分析器的扫描速度与飞行时间质量分析器或静电场轨道阱质量分析器的高分辨率和高质量准确度相结合,获得离子的准确分子量、元素组成,以及高分辨碎片离子质谱,用于待测成分的组成和结构分析。
(2)离子阱串联质谱
线性离子阱质量分析器可与飞行时间质量分析器或傅里叶变换质量分析器串联。将离子阱质量分析器的多级质谱功能与飞行时间质量分析器或傅里叶变换质量分析器的高分辨率和高质量准确度相结合,获得离子的准确分子量、元素组成,以及高分辨多级碎片离子质谱,用于待测成分的组成和结构分析。
(3)离子淌度串联质谱
离子淌度(Ion mobility)是一种将离子按照电荷、质量和形状分离的技术。离子淌度可与各种质谱仪和串联质谱仪联用,在质谱分析前对待测成分进行预分离,提高待测成分与干扰物的分离程度,提升检测的分辨率和灵敏度。
四、检测器
检测器由离子收集器、放大器构成。常用的离子收集器是法拉第圆筒,其精确度较高;电子倍增器、光电倍增管为常用的放大器,其灵敏度较高。
五、离子碎裂
离子碎片的质谱信息对于待测成分的定性和定量分析十分重要。不同的离子碎裂技术通过增加前体离子的内能,断裂化学键产生系列碎片离子或中性碎片分子,改善前体离子的碎裂效率,进而增加碎片离子的数量。常用的离子碎裂技术有碰撞诱导解离、电子活化解离、电子轰击解离、化学离子化解离等。
1.碰撞诱导解离(CID)
传输进入碰撞室的前体离子与氮、氩或氦等惰性气体分子发生碰撞,诱导前体离子发生裂解反应产生碎片离子。因为碰撞能量不同,碰撞诱导解离分为低能碰撞诱导解离与高能碰撞诱导解离。一般地,碰撞能量低于100eV称为低能碰撞。高能碰撞诱导解离(HCD)的能量可达数千eV,可产生更丰富的碎片离子。
2.电子捕获解离(ECD)和电子转移解离(ETD)
电子捕获解离是将自由电子引入带正电荷的气相分子,诱导前体离子化学碎裂,产生碎片离子。电子转移解离是将自由基阴离子引入带正电荷的气相分子,以诱导前体离子化学碎裂,产生碎片离子。ECD和ETD主要用于碎裂蛋白质和多肽,生成c-和z-型离子,因裂解能量较低,能保留更多待测成分的结构信息,用于解析蛋白质序列和表征蛋白质翻译后修饰。
3.电子活化解离(EAD)
进入碎裂室的离子捕获从垂直方向发射来的不同能量的电子,形成处于高能激发态的带电荷的自由基离子,化学键碎裂,形成碎片离子。可保留更多待测成分的结构信息,有助于表征多肽和蛋白质不稳定的翻译后修饰、药物代谢位点和多肽二硫键等。
六、数据采集方式
1.全扫描
全扫描(Full scan)是获得一级质谱的数据采集模式。通过对设定m/z范围内的全部离子进行扫描并记录质谱图,获得待测成分的准分子离子和分子量信息。
2.数据非依赖扫描
数据非依赖扫描(DIA)是获得二级质谱的数据采集模式。不预先挑选前体离子,将设定的m/z范围内的离子进行碎裂获得二级质谱,理论上能够获取所有前体离子的二级质谱。
3.数据依赖扫描
数据依赖扫描(DDA)是获得二级质谱的数据采集模式。选择满足一定条件的前体离子触发二级碎裂。常见的前体离子选择原则包括丰度、电荷、动态排除、质量亏损和背景扣除等。这种预先筛选前体离子的扫描模式能够排除非目标离子的干扰。
(1)产物离子扫描(product-ion scan)
在第一级质量分析器中选择某m/z的离子作为前体离子,测定该离子在第二级质量分析器中、一定m/z范围内的所有碎片离子的质荷比与相对强度,获得该前体离子的碎片信息。
(2)前体离子扫描(precursor-ion scan)
在第二级质量分析器中选择某m/z的产物离子,测定在第一级质量分析器中、一定m/z范围内所有能产生该碎片离子的前体离子。
(3)中性丢失扫描(neutral-loss scan)
以恒定的质量差异,在一定的m/z范围内同时测定第一级、第二级质量分析器中的所有前体离子和产物离子,以发现能产生特定中性碎片丢失的待测成分或同系物。
(4)选择离子监测(SIM)
选择能够表征待测成分的一个离子进行检测。
(5)选择反应监测(SRM)
选择第一级质量分析器中某前体离子(m/z)1,测定该离子在第二级质量分析器中的特定产物离子(m/z)2的强度,以定量分析复杂混合物中的低浓度待测成分。
(6)多反应监测(MRM)
是指同时检测两对及以上的前体离子-产物离子。
(7)平行反应监测(PRM)
是在第一级质量分析器中选择特定m/z的前体离子,第二级质谱分析器在宽的m/z范围内扫描,获得前体离子全部的产物离子信息,可准确定量每个产物离子。在定量分析特别是蛋白质定量分析中应用广泛,通常在高分辨质谱仪中应用。
七、仪器确证
质谱仪和色谱-质谱联用仪的确证可分为安装确证(IQ)、运行确证(OQ)和性能确证(PQ)。安装确证是确认相关硬件和软件已安装在适宜地点并能够正常开机运行。运行确证一般通过有代表性的关键仪器参数的运行,证明仪器运行指标符合要求。性能确证是通过标准物质或标准样品的分析,证明仪器的整体性能符合用户分析要求。
用于定性分析时,仪器的质量准确度是性能确证的重要指标。用于定量分析时,性能确证主要关注准确度、精密度和灵敏度。对已知标准的单电荷离子,误差应小于±0.50u。为了实现对建立的测量标准的良好控制,应根据使用的仪器和方法,制定相应的精密度判定标准。在全面考察质谱仪器的性能时,应根据使用的仪器和用途,选择适宜的方法、判定标准和时间间隔。
八、方法验证与确认
在方法验证中,应根据测量的质量属性,确定验证的性能参数,通常包括方法的专属性(亦称特异性)/选择性、基质效应、准确度、精密度、范围(包括校正曲线和范围低限)、耐用性等。为实现仪器在整个生命周期内的性能稳定性和可靠性,建议对所选质谱法的输出结果进行持续监测,确保分析结果的准确与可靠。
开展方法确认时,应根据用途对方法的专属性、准确度、精密度和定量限进行评价。
九、测定法
在进行样品分析前,应对测定用质谱仪进行质量校正。
1.定性分析
质谱法可用于药物、复杂代谢物和蛋白质等的分子量测定和结构鉴定。色谱-质谱联用法还广泛用于鉴定复杂基质中的药物及其代谢物、表征药物的杂质谱等研究。
(1)系统适用性
定性分析时,应考虑分辨率、质量范围和质量准确度,并根据分析方法的具体应用,对下列性能指标进行考察。
分辨率:质谱仪的单位质量分辨率应作为系统适用性试验参数。仪器性能确证程序对分辨率的要求能满足一般定性分析要求。
质量准确度:对于待测成分的单电荷离子,与对照品相比,±0.50u的质量准确度能满足一般定性分析要求。当需更高的质量准确度时,可另行规定判定标准。
(2)数据采集和分析
以质荷比为横坐标,以离子的相对丰度为纵坐标,测定待测成分的质谱。高分辨质谱仪可以测定待测成分的精确分子质量。
在相同的仪器及分析条件下,直接进样或联用进样,分别测定并比较待测样品和对照品的质谱数据。使用高分辨质谱、比对二级质谱信息或色谱保留时间,均可有效提高定性分析的准确性。质谱定性分析还可与核磁共振等其他分析技术相结合,更可靠地对药物、杂质或外源性污染物、极性大分子化合物等进行鉴别。复杂样品中待测成分的鉴定,应采用色谱-质谱联用仪或串联质谱仪。
质谱中不同质荷比离子的存在及其响应强度反映了待测成分的结构特征,结合串联质谱分析结果,可推测或确证待测成分的分子结构。当采用电子轰击离子源时,可通过比对待测成分的质谱图与标准谱库谱图的一致性,快速鉴定待测成分。对于未知待测成分的结构解析,通常需要综合应用多种质谱技术并考虑样品的来源和特点等信息,必要时还应结合元素分析、核磁共振、红外光谱、紫外光谱、X射线衍射等技术测定的结果综合判断。
2.定量分析
质谱法及色谱-质谱联用法可定量分析药物微量杂质、农药残留、外源性污染物、色素等,还可用于药物代谢动力学、临床药物浓度检测、疾病生物标志物检测等研究。
(1)系统适用性
与定性分析不同,除分辨率和质量准确度外,定量分析还应在方法中列出拟监测的离子(如质量范围、单个离子或MS/MS离子对),即离子选择。
应根据分析方法的具体应用,对下列性能指标进行考察。
分辨率:质谱仪的单位质量分辨率的要求能满足一般定量分析要求。当要求的分辨率大于单位质量时,可另行规定判定标准。
质量准确度:质谱仪的质量准确度能满足一般定量分析要求。当需更高的质量准确度,可另行规定判定标准。
精密度:与分析方法验证的重复性相比,系统适用性试验对精密度的要求更为严格。
线性:与分析方法验证的要求一致。
准确度:除满足分析方法验证的一般要求外,为保证分析质量,可将质量控制样品纳入分析批。通常情况下,质量控制样品中待测成分的浓度已知,样品制备方法应与待测样品相同。通过使用质量控制样品,可考察分析方法随时间变化的准确性。在准确度考察中应规定质量控制样品的数量或分析顺序。
定量限:当用于微量或痕量成分分析时,系统适用性试验应包括对定量限的评价,可用信噪比法或其他适宜的方法进行。
(2)数据采集和分析
采用选择离子监测、选择反应监测或多反应监测,外标法或内标法定量。内标化合物可以是待测成分的结构类似物或其稳定同位素(如2H,13C,15N)标记物。质谱定量分析一般需要使用每种待测成分的对照品。通过比较待测样品与采用适宜方法制备、浓度适宜的对照品中的待测成分的峰面积等质谱响应参数,实现定量分析。
为实现对待测成分和内标物色谱峰面积的准确积分,采集速率、扫描范围或监测质量等采集参数的设置,必须保证在峰宽范围内提供足够数量的采集点数。采集点数与方法性能要求、色谱条件、质谱仪类型、监测的待测成分和内标物的数量有关。例如采用四极杆质谱仪进行单个待测成分的检测时,在整个分析过程中质谱仪在SIM或SRM模式下交替采集待测成分和内标物色谱峰的数据。目前四极杆质谱仪每个采样点的停留时间可达100ms或更短,每个色谱峰上至少应有8个采集点数,以保证积分和定量准确。
定量分析宜采用标准曲线法。通过测定相同体积的系列标准溶液在特征m/z离子处的响应值,获得标准曲线及回归方程。按规定制备待测样品溶液,测定其在特征m/z离子处的响应值,代入标准曲线或回归方程计算,得到待测成分的浓度。定量分析复杂基质中药物及其代谢物、内源性代谢物和蛋白质时,通常采用内标校正的标准曲线法。内标校正的标准曲线法是将等量的内标加入系列标准溶液中,测定待测成分与内标物在各自特征m/z离子处的响应值,以响应值的比值为纵坐标,待测成分浓度或者待测成分浓度与内标物浓度的比值为横坐标绘制标准曲线,计算回归方程。使用稳定同位素标记物作为内标时,可获得更好的分析精密度和准确度。